La Revolución de los Biosimilares
Por Maria Monllaó
Con los biosimilares tratamos igual de bien a los pacientes que con los biológicos originales
– declara Carles Iniesta, Hospital Universitario Reina Sofía de Murcia, al comparar el perfil farmacocinético y la capacidad de producir inmunogenicidad de un fármaco, en este caso Infliximab y el biosimilar.
España se encuentra en un momento crucial al necesitar un plan para la segunda revolución biosimilar dado que, entre el 2024 y el 2029, van a expirar cien patentes de medicamentos biológicos.
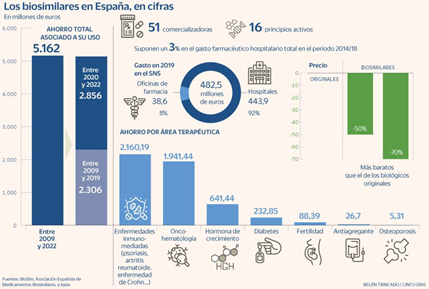
Accesibilidad de pacientes
En 2005, los biosimilares irrumpieron en el SNS (Sistema Sanitario Nacional) aportando así dos ventajas claras:
- mayor acceso de los pacientes a tratamientos biológicos
- un significativo ahorro en el gasto farmacéutico, dado que el precio es entre un 50-70% más bajo que los biológicos (en 2021, se ahorró al SNS un 11% en gasto farmacéutico, es decir, 937 millones de euros)
Según Daniel Callejo, jefe del equipo de investigación en resultados de IQVIA:
Este tiempo de transición debe servir para impulsar acciones que permitan explotar este beneficio; se tiene que educar y dar a conocer estos productos, explicando sus ventajas tanto a profesionales como a pacientes.
Sostenibilidad del sistema
Los medicamentos biológicos han supuesto un importante desarrollo en el tratamiento de patologías, en su mayoría –aunque no únicamente- graves y crónicas. En varios casos, son medicamentos terapéuticamente fundamentales cuyo coste medio es, sin embargo, bastante superior al de los medicamentos de síntesis química. Los biosimilares —productos biológicos equivalentes con menor coste– contribuyen pues al ahorro en la factura farmacéutica, sin minimizar la entrada a terapias biológicas de calidad.
César A. Rodríguez, coordinador del grupo de trabajo de la Sociedad Española de Oncología Médica (SEOM), advierte y aconseja sobre la importancia de los biosimilares en su utilización:
Tienen un impacto en la sostenibilidad del sistema y estimulan la investigación y la competencia entre laboratorios”. Los ahorros obtenidos deben “reinvertirse en una mejora de la calidad asistencial de los pacientes, compra de tecnología, etc.
Sin embargo, una dificultad para estos fármacos consiste en llegar a la farmacia comunitaria, ya que sólo el 8% de los biosimilares pueden adquirirse en farmacias. Por ello, puede considerarse que se está perjudicando la accesibilidad de los pacientes por una cuestión de precio.
Acceso a productos innovadores
Los biosimilares permiten un mayor acceso a los pacientes a tratamientos innovadores a través de dos mecanismos. Por un lado, el ahorro hospitalario puede reconducirse hacia nuevas opciones terapéuticas biológicas que hoy en día no son costeables para pacientes que puedan requerirlas. Por otro lado, promueve la competencia entre compañías farmacéuticas, favoreciendo la investigación de nuevos productos.
Desarrollo de biosimilares
Se requiere que los fabricantes de biosimilares demuestren a través de estudios exhaustivos de comparabilidad con el medicamento biológico de ‘referencia’ que su medicamento biológico es altamente similar al medicamento de referencia. En consecuencia, tanto en los estudios que no son clínicos como en los ensayos clínicos, no deben detectarse diferencias importantes en lo relativo a calidad, eficacia y seguridad entre los dos medicamentos.
La EMA pide que los elaboradores de biosimilares entreguen los datos de toxicología de los estudios no clínicos y los resultados de los estudios de farmacocinética (PK), farmacodinamia (PD), efectividad y estabilidad de los ensayos clínicos. Todo ello, a diferencia de los medicamentos genéricos que solo necesitan proporcionar los datos no clínicos y los clínicos de PK y PD de un diminuto número de sujetos.
Por consiguiente, un fabricante de biosimilares tiene que hacer estudios no clínicos, que constan de estudios in vitro e in vivo (si se estima necesario). Respecto a los estudios clínicos, en etapa 1 deben demostrar que la PK y la PD son equiparables y en etapa 3, demostrar la efectividad clínica y estabilidad. Una vez se demuestra la comparabilidad de los biosimilares en una indicación, podría ser aceptable la extrapolación de datos clínicos a otras indicaciones del producto de referencia.

 Marketing Farmacéutico
Marketing Farmacéutico





